Física y Química :
3º ESO , 4º ESO y 1º Bachillerato.
Biología y Geología :
3º ESO.
jueves, 30 de septiembre de 2010
CONFIGURACIÓN ELECTRÓNICA - 4º ESO
CONFIGURACIÓN ELECTRÓNICA
Se entiende por configuración electrónica la distribución más estable, y por tanto, más probable de los electrones en torno al núcleo.
Para distribuir los electrones en los distintos niveles de energía tenemos en cuenta los siguientes pricipios y reglas:
- Principio de relleno o Aufbau. Los electrones entran en el átomo en los distintos orbitales de energía ocupando primero los de menor energía.
Aspectos espaciales de los orbitales atómicos.-
- Los orbitales s (l=0) son esféricos. Su volumen depende del valor de n.
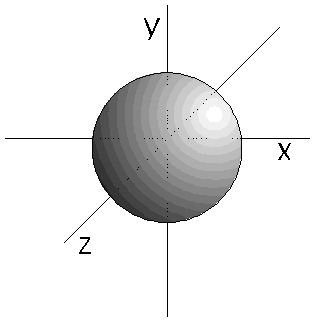
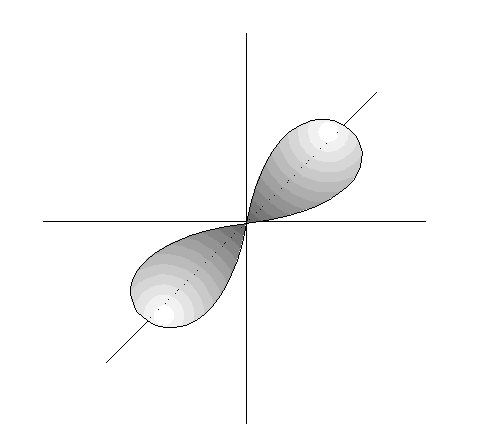
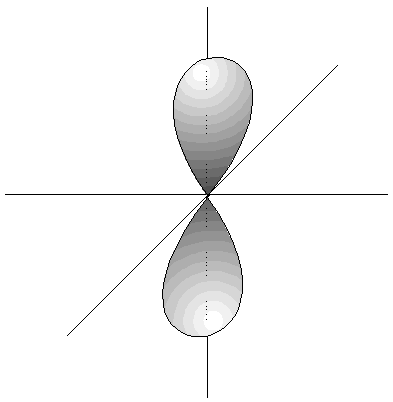
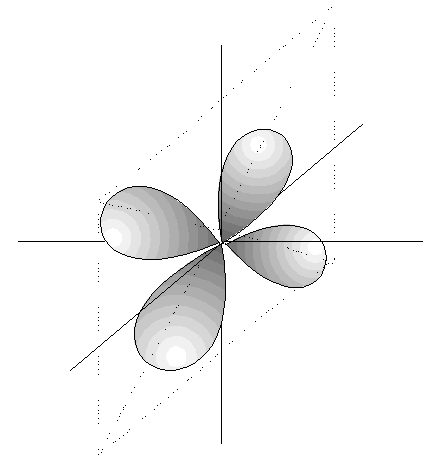
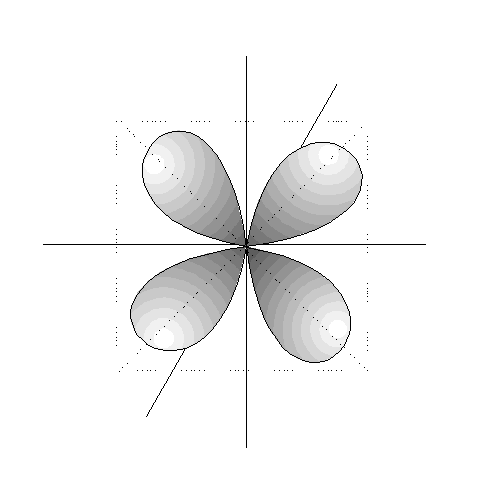
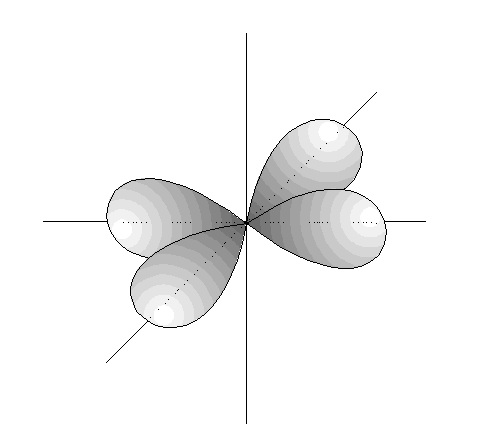
- Los orbitales p son 3, tienen forma de 2 lóbulos unidos por los extremos y orientados en la dirección de los 3 ejes del espacio.

- Los orbitales d son 5, cuya disposición y orientación dependen de los valores de m.




 Para saber el orden de energía de los orbitales se usa el diagrama de Mouller.
Para saber el orden de energía de los orbitales se usa el diagrama de Mouller.
O Bien se sigue esta regla: "Los orbitales menos energéticos son los de menor valor de n+l. Si los orbitales tienen el mismo valor de n+l, tandrá menos energía los de menor valor de n".De acuerdo con estas reglas el orden es el siguiente:1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7sSin embargo, este orden teórico presenta algunas excepciones. Por ejemplo, en las configuraciones de los lantánidos, aunque en teoría los orbitales 4f son más energéticos que los 5d, en realidad el átomo coloca primero un electrón en el 5d que entonces se vuelve más energético, y empieza a rellenar los 4f.
- Principio de exclusión de Pauli. No pueden existir dentro de un átomo dos electrones con sus 4 números cuánticos iguales. La consecuencia de esto es que en un orbital sólo puede haber 2 electrones con spines diferentes.
- Principio de Hund o de máxima multiplicidad. Un segundo electrón no entra en un orbital que esté ocupado por otro mientras que haya otro orbital desocupado de la misma energía (o sea, igual los valores de n y l)
PARA SABER MÁS:
ESTRUCTURA ATÓMICA
LEYES PONDERALES - 1º BACHILLERATO
lunes, 27 de septiembre de 2010
CÉLULAS 3º ESO - MATERIAL DESCARGABLE
HOJA 1
HOJA 2
HOJA 3
HOJA 4
CÉLULA ANIMAL
CÉLULA VEGETAL
LISOSOMA
CITOCENTROS
APARATO DE GOLGI
MITOCONDRIA
RETÍCULO ENDOPLASMÁTICO
VARIEDAD DE FORMAS CELULARES
LA MATERIA Y SUS PROPIEDADES - 1º BACHILLERATO
En esta unidad didáctica se repasan conceptos ya conocidos, como los estados de agregación de la materia que se interpretan a partir de la teoría cinética; y se realiza una clasificación de los sistemas materiales en homogéneos y heterogéneos, procediendo a la descripción de los mismos, definiendo e identificando ejemplos de mezclas homogéneas y sustancias puras, compuestos y elementos. Es la base para abordar las leyes fundamentales de la Química.
ORIENTACIONES DIDÁCTICAS
1. Materia homogénea y heterogénea
Se puede introducir la unidad revisando las ideas sobre la clasificación de los sistemas materiales en homogéneos y heterogéneos, aportando ejemplos de cada uno de ellos. La introducción del concepto de fase, como cada una de las partes homogéneas de un sistema, es muy importante, así como comprender que una fase homogénea puede estar constituida por una sustancia o por una disolución.
2. Sustancias, mezclas y soluciones
Es importante resaltar que el concepto de sustancia en química no coincide con el de sustancia en el lenguaje de la vida cotidiana. Así, en el lenguaje corriente se puede decir que la leche es una sustancia, pero en química este término se reserva para las sustancias puras. Con todo, la denominación sustancia pura es redundante, puesto que una porción de materia, si no es pura, no es realmente una única sustancia. La denominación sustancia química o especie química es más adecuada.
3. Dispersiones coloidales
La definición de dispersión coloidal como una mezcla heterogénea que precisa de un microscopio para distinguir sus fases es una primera aproximación a la comprensión del concepto, que debe ser complementada con una visión microscópica del tamaño de las partículas coloidales.
Recalcar que la apariencia física de una dispersión coloidal corresponde al estado físico de la fase dispersante e ilustrarlo con ejemplos: sol, emulsión, emulsión sólida, aerosol sólido y líquido, espuma…
4. Disoluciones saturadas, insaturadas y sobresaturadas
El concepto de solubilidad de una sustancia va ligado al concepto de disolución saturada. Es importante notar que la manera habitual de expresar la solubilidad difiere de la manera en que se expresa la concentración en masa de una disolución, ya que la masa máxima de soluto que se disuelve se refiere a una determinada masa de disolvente y no a la masa o el volumen de la disolución que se forma.
Los alumnos deben diferenciar entre disolución insaturada, saturada y sobresaturada, y saber la posición que ocupan estas disoluciones en los diagramas que representan la curva de solubilidad de una sustancia. También es muy importante diferenciar los conceptos de disolución concentrada y diluida de los conceptos de disolución insaturada y saturada.
5. Separación de mezclas
Los métodos de separación de mezclas permiten determinar si una muestra es una sustancia pura. El cuadro resumen de los métodos de separación de mezclas de la página 200 es una buena síntesis de estos métodos, basada en la diferente propiedad en la que se fundamenta cada uno de ellos.
Conviene prestar atención al aprendizaje de los términos que sirven para designar cada uno de los procesos físicos y de los instrumentos que intervienen en los métodos de separación. Se recomienda que los estudiantes sean capaces de diseñar métodos de separación para determinadas mezclas, expresándolos mediante esquemas o diagramas de flujo como el de la página 203; y que sepan llevarlos a la práctica en el laboratorio.
6. Sustancias químicas
Es recomendable analizar la información que presentan las etiquetas de los productos químicos: nombre del producto, símbolo de peligrosidad, riesgos y consejos de seguridad, fórmula, grado de pureza, relación de impurezas, etc. También es conveniente realizar en el laboratorio una grafica de fusión o de solidificación de una sustancia, como criterio de su grado de pureza.
7. Cambios físicos y químicos
No siempre es tarea fácil distinguir entre cambios físicos y químicos. La visión de los cambios estructurales que se producen en las sustancias es esencial para comprender la naturaleza del cambio químico. Por el contrario, la conservación de la masa es un hecho que se produce tanto en los cambios físicos como en los químicos. Es importante interpretar correctamente los cambios químicos en los que parece no cumplirse este principio por el hecho de desprenderse gases.
8. Sustancias elementales y sustancias compuestas
El criterio de diferenciación entre sustancias simples y compuestas que se establece en esta unidad es de tipo operacional. Se debe ser consciente de que una comprensión clara de esta diferencia no puede obtenerse hasta contemplar la diferente composición y estructura interna de estas sustancias, por lo que lo más recomendable es trabajar simultáneamente ambas visiones, la macroscópica y la microscópica.
Las sustancias simples son también a veces denominadas “elementos”. Se recomienda diferenciar este término del que se utilizará posteriormente como átomo.
domingo, 26 de septiembre de 2010
CÉLULAS 3º ESO - TERCERA PARTE
7. Células especializadas. Los tejidos
CONTENIDOS DEL EPÍGRAFE 7
Las diferencias morfológicas entre las células están relacionadas con las funciones que realizan.
Las células especializadas se coordinan y organizan en unas estructuras llamadas tejidos.
8. Tipos de tejidos. El tejido epitelial y el nervioso
CONTENIDOS DEL EPÍGRAFE 8
Existen cuatro tipos básicos de tejido: epitelial, conectivo, muscular y nervioso.
Tipos, localización y función del tejido epitelial.
Localización y función del tejido y las células nerviosas.
SUGERENCIAS DIDÁCTICAS
Relacionar cada tejido con su función es un trabajo memorístico que debe ayudarse de la realización de tablas y de ejercicios que ayuden al alumno a fijar los conocimientos. A continuación se muestra un posible ejemplo de formato de estas tablas.
Tejido epitelial | Tejido nervioso | |
Función | El de revestimiento tiene una función protectora, y en el glandular las células están especializadas en producir y segregar sustancias. | Recoge la información del exterior y el interior y la transmite por el organismo. |
9. Los tejido conectivos y el tejido muscular
CONTENIDOS DEL EPÍGRAFE 9
Tipos y funciones de los tejidos conectivos.
Tipos y funciones del tejido muscular.
SUGERENCIAS DIDÁCTICAS
Puesto que este epígrafe es continuación del anterior, deben seguir visualizándose tejidos y realizándose esquemas y tablas en los que se incluyan la estructura, función y localización de los distintos tejidos. De igual manera, se muestra un posible ejemplo de estas tablas.
Estructura | función | localización | |
Tejido epitelial | …… | …… | Recubre la superficie externa del cuerpo y el interior y exterior de los órganos. |
Tejido nervioso | Las principales células nerviosas son las neuronas. Ocupando el espacio entre ellas están las células gliales. | …… | …… |
Tejido conectivo | …… | …… | Ocupa el espacio entre órganos, vasos sanguíneos y nervios. |
Tejido muscular | …… | Es el responsable del movimiento de las diferentes partes del organismo. | …… |
10. Órganos y sistemas de órganos
CONTENIDOS DEL EPÍGRAFE 10
Los tejidos se agrupan formando órganos.
Cuando la actividad de los órganos está estrechamente relacionada se habla de aparatos o sistemas.
11. Trasplantes
CONTENIDOS DEL EPÍGRAFE 11
Qué es un trasplante, qué puede trasplantarse (células, tejido, órganos o grupos de órganos) y quiénes participan en el proceso (donante y receptor).
La donación y tipos de donantes, personas con muerte cerebral o vivas.
Compatibilidad entre donante y receptor y el rechazo de un trasplante por el receptor.
Tipos de trasplante según la proximidad genética entre donante y receptor: autotrasplante, isotrasplante, alotrasplante y xenotrasplante.
La ley de trasplantes de España y sus puntos fundamentales.
viernes, 24 de septiembre de 2010
CÉLULAS 3º ESO - SEGUNDA PARTE
4. La membrana y los intercambios con el medio
CONTENIDOS DEL EPÍGRAFE 4 La membrana es primordial en el intercambio de materia.
Las moléculas pequeñas atraviesan la membrana por difusión y transporte activo, y las grandes por endocitosis y exocitosis.
SUGERENCIAS DIDÁCTICAS
- Transporte pasivoTransporte activoMoléculas pequeñasMoléculas pequeñasSin gasto energéticoCon gasto energéticoA favor de gradiente de concentraciónEn contra de gradiente de concentración
5. El funcionamiento de la célula
CONTENIDOS DEL EPÍGRAFE 5
Las células desarrollan su actividad coordinando el funcionamiento de todos sus orgánulos.
6. El metabolismo celular
CONTENIDOS DEL EPÍGRAFE 6
El metabolismo es el conjunto de reacciones químicas celulares. El anabolismo construye moléculas complejas y el catabolismo extrae energía de las moléculas.
La célula se encuentra rodeada de un líquido intersticial que forma el medio interno.
miércoles, 22 de septiembre de 2010
MODELOS ATÓMICOS - 4º
Cinco siglos antes de Cristo, los filósofos griegos se preguntaban si la materia podía ser dividida indefinidamente o si llegaría a un punto, que tales partículas, fueran indivisibles. Es así, como Demócrito formula la teoría de que la materia se compone de partículas indivisibles, a las que llamó átomos (del griego átomos, indivisible).
En 1803 el químico inglés John Dalton propone una nueva teoría sobre la constitución de la materia. Según Dalton toda la materia se podía dividir en dos grandes grupos: los elementos y los compuestos. Los elementos estarían constituidos por unidades fundamentales, que en honor a Demócrito, Dalton denominó átomos. Los compuestos se constituirían de moléculas, cuya estructura viene dada por la unión de átomos en proporciones definidas y constantes. La teoría de Dalton seguía considerando el hecho de que los átomos eran partículas indivisibles.
Hacia finales del siglo XIX, se descubrió que los átomos no son indivisibles, pues se componen de varios tipos de partículas elementales. La primera en ser descubierta fue el electrón en el año 1897 por el investigador Sir Joseph Thomson, quién recibió el Premio Nobel de Física en 1906. Posteriormente, Hantaro Nagaoka (1865-1950) durante sus trabajos realizados en Tokio, propone su teoría según la cual los electrones girarían en órbitas alrededor de un cuerpo central cargado positivamente, al igual que los planetas alrededor del Sol. Hoy día sabemos que la carga positiva del átomo se concentra en un denso núcleo muy pequeño, en cuyo alrededor giran los electrones.
El núcleo del átomo se descubre gracias a los trabajos realizados en la Universidad de Manchester , bajo la dirección de Ernest Rutherford entre los años 1909 a 1911. El experimento utilizado consistía en dirigir un haz de partículas de cierta energía contra una plancha metálica delgada, de las probabilidades que tal barrera desviara la trayectoria de las partículas, se dedujo la distribución de la carga eléctrica al interior de los átomos.
Modelo Atómico de Dalton
Aproximadamente por el año 1808, Dalton define a los átomos como la unidad constitutiva de los elementos (retomando las ideas de los atomistas griegos). Las ideas básicas de su teoría, publicadas en 1808 y 1810 pueden resumirse en los siguientes puntos:
- La materia está formada por partículas muy pequeñas para ser vistas, llamadas átomos.
- Los átomos de un elemento son idénticos en todas sus propiedades, incluyendo el peso.
- Diferentes elementos están formados por diferentes átomos.
- Los compuestos químicos se forman de la combinación de átomos de dos o más elementos, en un átomo compuesto; o lo que es lo mismo, uncompuesto químico es el
resultado de la combinación de átomos de dos o más elementos en una proporción numérica simple. - Los átomos son indivisibles y conservan sus características durante las reacciones químicas.
- En cualquier reacción química, los átomos se combinan en proporciones numéricas simples.
- La separación de átomos y la unión se realiza en las reacciones químicas. En estas reacciones, ningún átomo se crea o destruye y ningún átomo de un elemento se convierte en un átomo de otro elemento.
Modelo Atómico de Thomson
Thomson sugiere un modelo atómico que tomaba en cuenta la existencia del electrón, descubierto por él en 1897. Su modelo era estático, pues suponía que los electrones estaban en reposo dentro del átomo y que el conjunto era eléctricamente neutro. Con este modelo se podían explicar una gran cantidad de fenómenos atómicos conocidos hasta la
Modelo Atómico de Rutherford
Basado en los resultados de su trabajo, que demostró la existencia del núcleo atómico, Rutherford sostiene que casi la totalidad de la masa del átomo se concentra en un núcleo central muy diminuto de carga eléctrica positiva. Los electrones giran alrededor del núcleo describiendo órbitas circulares. Estos poseen una masa muy ínfima y tienen carga eléctrica negativa. La carga eléctrica del núcleo y de los electrones se neutralizan entre sí, provocando que el átomo sea eléctricamente neutro.
Modelo Atómico de Bohr
El físico danés Niels Bohr ( Premio Nobel de Física 1922), postula que los electrones giran a grandes velocidades alrededor del núcleo atómico. Los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía. El electrón puede acceder a un nivel de energía superior, para lo cual necesita "absorber" energía. Para volver a su nivel de energía original es necesario que el electrón emita la energía absorbida ( por ejemplo en forma de radiación). Este modelo, si bien se ha perfeccionado con el tiempo, ha servido de base a la moderna física nuclear. Este propuso una Teoría para describir la estructura atómica del Hidrógeno, que explicaba el espectro de líneas de este elemento.
MODELOS ATÓMICOS
LA CÉLULA - 3º - PRIMERA PARTE
INTRODUCCIÓN
Todos los seres vivos están compuestos por células, desde los más diminutos a los de mayor tamaño. Estas estructuras microscópicas poseen una gran complejidad morfológica y funcional.
El nivel más alto de organización se alcanza cuando en los seres pluricelulares, animales y vegetales, las células se organizan en tejidos, los tejidos en órganos y los órganos en aparatos o sistemas.
Los tejidos y órganos humanos poseen unos doscientos tipos de células diferentes perfectamente coordinadas entre sí. Este complejo engranaje forma parte de una gran obra de arquitectura, el cuerpo humano, y, por supuesto, hace posible la vida.
OBJETIVOS
Conocer la estructura y el funcionamiento celular.
Conocer los niveles de organización superiores al celular en el ser humano: tejidos, órganos y aparatos o sistemas.
1. Nuestro organismo está formado por células
CONTENIDOS DEL EPÍGRAFE 1
Nuestro organismo está formado por células.
Los organismos pueden estar formados por una sola célula o por muchas células.
Los elementos comunes a todas las células de nuestro cuerpo son: membrana, citoplasma y núcleo celular.
2. Los orgánulos de una célula humana
CONTENIDOS DEL EPÍGRAFE 2
La célula está constituida por distintos orgánulos y estructuras.
Los orgánulos desempeñan funciones variadas en la célula.
3. El núcleo de la célula
CONTENIDOS DEL EPÍGRAFE 3
En las células procarióticas el material genético está disperso por el citoplasma; en las eucarióticas está separado por una membrana.
El núcleo está formado por varios componentes.
La cromatina es el ADN de la célula en reposo; cuando la célula se va a dividir se compacta y forma los cromosomas.
Las células animales y vegetales tienen algunos elementos comunes y otros diferentes, consecuencia de su función.
Suscribirse a:
Entradas (Atom)













